Veijo Hänninen
Uuden polven akkuratkaisuja
Akkujen kysynnän kasvaessa nopeasti litiumin ja koboltin resurssit käyvät yhä niukemmiksi. Tämä on merkittävä kannustin kehittää uusia akkujärjestelmiä.
 Esimeriksi Li-ioni-akkujen tutkimustavoite keskittyy elektrodien ja elektrolyyttien suoritusarvojen nostamiseen yhä korkeammille energiatiheyksille.
Esimeriksi Li-ioni-akkujen tutkimustavoite keskittyy elektrodien ja elektrolyyttien suoritusarvojen nostamiseen yhä korkeammille energiatiheyksille.
Mutta tutkijat etsivät nyt myös aivan toisenlaisia akkuratkaisuja joissa huomioidaan myös materiaalien saatavuus ja ympäristöasiat sekä turvallisuus.
Kahden ionin akut
Kahden ionin akuissa (DIB) sekä kationit että anionit osallistuvat sähkökemiallisiin redox-reaktioihin. Ne ovat herättäneet laajaa huomiota korkeasta työjännitteestään, edullisista kustannuksistaan, kierrätyksen helppoudesta ja vähäisistä ympäristövaikutuksista johtuen. Ensimmäiset kokeilut aiheesta julkaistiin 1980-luvun lopulla.
Näissä akuissa anioni interkalatoituu katodiin latauksen aikana, mikä johtaa sekä nykyisistä poikkeavaan sähkökemialliseen energian varastointijärjestelmään että korkeaan työjännitteeseen. Koska anionit tulevat elektrolyytistä, myös elektrolyytit ajatellaan aktiivisina materiaalina eli varaus-purkaus prosessissa anionit ja kationit erotetaan ja yhdistyvät uudelleen elektrolyytissä.
Tämä tarkoittaa myös, että tarvitaan suuria määriä elektrolyyttiliuoksia kaikille niille ioneille joita tarvitaan elektrodien täydelliseen varaamiseen ja purkamiseen. Tästä johtuen näitä akkuja ajateltiin alkuun käytettävän sähköverkkojen akkuina tuuli- tai aurinkosähkölle.
Näitä akkuja on kokeiltu erilaisina kemiallisina yhdistelminä mutta tavanomaisimmat ratkaisut soveltavat grafiittia molempina elektrodeina ja elektrolyytteinä orgaanisten liuottimien ja litiumsuolojen yhdistelmiä.
Mutta niihin liittyy myös joitakin ongelmia kuten interkalaatiotyyppisten grafiittielektrodien rajallinen kapasiteetti.
Interkalaatio tarkoittaa kemiallista reaktiota, jossa atomi, ioni tai molekyyli sijoittuu kerrosmaisen yhdisteen tai alkuainekerrosten väliin muodostamatta kuitenkaan kovalenttista sidosta isäntämolekyylin kanssa.
Myös elektrolyyttien hajoaminen korkeissa jännitteissä on ollut ongelmana, joten tutkijat hakevat innokkaasti myös muita lähestymistapoja.
Hapettava anionin lisäys
Palautettavissa oleva hapettava anionin lisäys ja pelkistävä kationin lisäys ovat kaksi kiintoaineen sähkökemiallista perusprosessia.
Kationin lisäysreaktiot ovat helpottaneet keinutuolityyppisiä akkuja, kuten Li-ioni-akkuja, joissa kationi varauskantajana liikkuu kahden elektrodin välillä varauksen neutraalisuuden saavuttamiseksi.
Hapettava anionin insertio kiinteisiin aineisiin on kuitenkin saanut paljon vähemmän huomiota, vaikka se on ollut tiedossa jo vuodesta 1938 lähtien.
Elektrodit, jotka isännöivät anioneja voivat toimia katodeina kaksoisioniakuissa (DIB) tai anodeina käänteisessä kaksoisionissa (RDIB) akuissa, niiden toimintapotentiaalista riippuen.
Näissä akuissa anionit ja kationit siirtyvät vastakkaisiin suuntiin kahden elektrodin suhteen varaamisen tai purkamisen aikana.
Grafiittia molemmin puolin
Alkuun kaksoisioniakkuja kehitettiin hiilimateriaalin toimiessa sekä anodina että katodina.
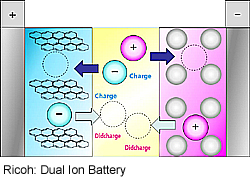 Japanilainen Ricoh tunnetaan kopiokoneissa käytettävien hiili- ja orgaanisten materiaalien alalta ja yhtiö lähtikin hyödyntämään osaamistaan näihin akkuihin.
Japanilainen Ricoh tunnetaan kopiokoneissa käytettävien hiili- ja orgaanisten materiaalien alalta ja yhtiö lähtikin hyödyntämään osaamistaan näihin akkuihin.
Ricoh on kehitellyt kaksoisioniakkuja, joilla on pieni sisäinen vastus. Näin ne mahdollistavat nopean lataamisen ja purkamisen myös silloin, kun vahva regeneratiivinen toiminta tuottaa suuria virtoja, jollaisia tavanomaiset litiumioniakut eivät voi hyödyntää.
Sittemmin näissä akuissa grafeenin avuksi on liitetty alumiinifoliota aktiiviseksi katodimateriaaliksi ja virrankerääjäksi.
Kun ionit jäävät ansaan
Kaksoisionien kenno tarjoaa huomattavan liikkumavaran uusien akkujen suunnittelulle. Uudenlaisesta suunnittelun lähtökohdasta huolimatta, tähän mennessä anionien isäntäelektrodeista on ollut niukkuutta eri tutkimusraporteissa.
Mutta äskettäin Oregonin osavaltion yliopiston (OSU) tutkimuksissa havaittiin, että loukkuun jääneet ionit voivat avata polun parempiin akkuihin ja paljon muuhun
Monet tieteen merkittävimmät haasteet jäljittävät tunnettujen saatavilla olevien materiaalien rajoja, mutta OSU:n tiedeakatemian tutkijoiden "vasta-ionien lisäys" -niminen ilmiö avaa oven "suurelle joukolle uusia kiinteitä aineita, joiden arvot ylittävät eri tieteenalat kaukana akkukemioista”, kertoo kemian apulaisprofessori Xiulei Ji. "Tämä on täysin uuden kentän lähtökohta."
Esimerkiksi akuilla, jotka on suunniteltu tätä rakennetta käyttäen, on huomattava potentiaali edulliseen energiaan varastointiin, Ji visioi.
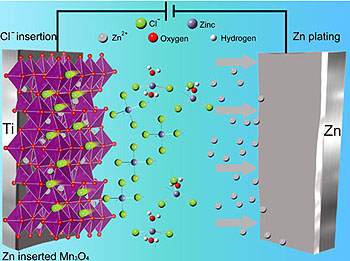
Ionivarastoinnin kemian tutkimiseksi kiinteissä aineissa - erityisesti anionien tarkasteleminen kationien sijasta - Ji ja Ph.D. opiskelija Heng Jiang testasivat mangaanioksidia Mn3O4 elektrodina sinkki-ioni akussa.
Sinkki-ionien sijoittamisen testi epäonnistui, mutta sen sijaan se tuotti ennennäkemättömän kloridi-akkuelektrodin, mikä osoitti, että anionia isännöivät akut toimivat paremmin, sen jälkeen kun kationit ovat jääneet loukkuun elektrodeissa.
 "Odotamme, että tämä merkitsee vasta-ionin lisäyksen käyttöönottoa yleisenä sähkösynteesimenetelmänä materiaalien suunnittelussa". Suurin osa akuista, Ji selittää, varastoi sähköä kationien kautta. "On vähemmän sellaisia tunnettuja materiaaleja, jotka voivat varastoida palautuvasti anioneja kuin varastoida kationeja".
"Odotamme, että tämä merkitsee vasta-ionin lisäyksen käyttöönottoa yleisenä sähkösynteesimenetelmänä materiaalien suunnittelussa". Suurin osa akuista, Ji selittää, varastoi sähköä kationien kautta. "On vähemmän sellaisia tunnettuja materiaaleja, jotka voivat varastoida palautuvasti anioneja kuin varastoida kationeja".
"Esimerkki kationin varastoinnista on litium-ionien vastasuuntainen lisäys, mikä johti litium-ioni-akkujen tekniikkaan." Litiumioniakut toimivat hyvin, koska varastoitava kationi on pieni ja kevyt.
Tässä tapauksessa anionien varastointia varten toivotut anionit ovat halogenideja - yksi halogeeniatomi yhdellä ylimääräisellä elektronilla. Jodi, bromi, kloori ja fluori ovat halogeeneja ja niiden anionit tunnetaan jodidina, bromidina, kloridina ja fluoridina.
"Kloridi on suhteellisen kevyt ja pieni verrattuna muun tyyppisiin anioneihin, joita on kokeiltu kuten isojen polyatomisten ionien kanssa. Nitraatilla, sulfaatilla ja heksafluorifosfaatilla on taipumus vääristää elektrodirakenteita vähitellen", Ji selventää.
Tutkijoiden mukaan palautuvan kloridin varastointi Zn-ioni-ansoittuneessa Mn3O4:ssä on esimerkki yleisestä sähkösynteesimenetelmästä, toisin sanoen vasta-ionien lisäysmekanismista, jossa palautumaton ioniansoitus isännässä muuttaa niiden sähkökemiallisia ominaisuuksia vastakkaisten sähkövarausten vasta-ionien varastoimiseksi akkuelektrodina.
Tutkimusjulkaisu: Counter‐ion insertion of chloride in Mn3O4 as cathode for dual‐ion batteries: A new mechanism of electrosynthesis for reversible anion storage.
Elektrolyytin jakaen
Kiinan Tianjinin yliopiston ovat juuri äskettäin ottaneet käyttöön uuden, vähän vastaavanlaisen, suunnittelustrategian, joka voisi parantaa sinkkimangaanidioksidia (Zn - MnO2) sisältävien akkujen suorituskykyä.
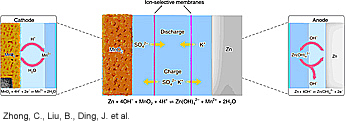 Heidän kehittämä lähestymistapa erottelee elektrolyytit akun sisällä omiksi optimaalisiksi redox-kemian toteuttajiksi sekä Zn- että MnO2 -elektrodeissa.
Heidän kehittämä lähestymistapa erottelee elektrolyytit akun sisällä omiksi optimaalisiksi redox-kemian toteuttajiksi sekä Zn- että MnO2 -elektrodeissa.
MnO2-katodin ja Zn-anodin toiminnan olosuhteet kytketään erilleen, jotta mahdollistetaan sekä happamia MnO2 ja emäksisiä Zn redox reaktioita samassa kennossa. Tuloksena olevalla (electrolyte-decoupling strategy DZMB) akulla on paljon suurempi käyttöjännite ja pidempi työjaksoikä kuin perinteisillä alkalipitoisilla Zn-MnO2 -akuilla.
Jatkossa professori Zhongin ja hänen kollegoidensa käyttöön ottamaa uutta suunnittelustrategiaa voitaisiin käyttää tuottamaan uusia Zn-MnO2 -akkuja, jotka ovat edullisia ja turvallisia, mutta joilla on myös poikkeuksellisen korkeat avoimen piirin jännitteet ja pidentynyt työjaksojen käyttöikä. Erityisesti samaa strategiaa voitaisiin käyttää myös parantamaan muiden sinkkipohjaisten vesiparistojen, kuten Zn-Cu- ja Zn-Ag-koostumusten suorituskykyä.
Protonit käyttöön
Ionien lisäksi akuissa voidaan ottaa käyttöön myös protonit, jotka kuitenkin vedyn tapauksessa ovat ioneja.
Myös protoniakut voidaan tehdä luonnon runsaista materiaaleista eikä niiden tuottaminen synnytä hiiliemissioita.
Australialaisen Royal Melbourne Institute of Technology (RMIT) Universityn tieteilijät osoittivat jo vuonna 2018 toimivan ja ladattavan protonipariston.
 Tässä prototyypissä käytettiin vetyvarastona hiilielektrodia yhdistettynä palautuvaan polttokennoon sähkön tuottamiseksi. Hiilielektrodi ja veden protonit antavat protoniakulle ympäristöllisen, energian ja potentiaalisen taloudellisen edun, totesi johtava tutkija professori John Andrews.
Tässä prototyypissä käytettiin vetyvarastona hiilielektrodia yhdistettynä palautuvaan polttokennoon sähkön tuottamiseksi. Hiilielektrodi ja veden protonit antavat protoniakulle ympäristöllisen, energian ja potentiaalisen taloudellisen edun, totesi johtava tutkija professori John Andrews.
Akku ja polttokenno yhdistäen
Prototyyppinen protoniparisto yhdistää vetypolttokennojen ja akkupohjaisen sähkön parhaat puolet. Kun yhdistetään hiilielektrodi vedyn kiinteän olomuodon varastointiin ja palautuva polttokenno, niin saadaan integroitu ladattava yksikkö.
Lataamisen aikana palautuvassa polttokennossa veden pilkkomisella tuotetut protonit johdetaan kennokalvon läpi ja ne sitoutuvat suoraan varastomateriaaliin syötetyn jännitteen syöttämien elektronien avulla vetykaasua muodostamatta.
Sähkönsyöttötilassa tämä prosessi on päinvastainen; vetyatomeja vapautuu varastosta ja ne menettävät elektronin tullen taas protoneiksi. Nämä protonit kulkevat sitten takaisin kennokalvon läpi, missä ne yhdistyvät hapen ja ulkoisen piirin elektronien kanssa muodostaen uudelleen vettä.
Protonipariston merkittävä potentiaalinen etu on paljon suurempi energiatehokkuus kuin tavanomaisissa vetyjärjestelmissä, joten se on verrattavissa litium-ioniakkuihin. Vetykaasun kehitykseen ja protoneihin jakautumiseen liittyvät menetykset eliminoitiin.
Kokeelliset tulokset osoittivat, että fenolihartsista valmistettu huokoinen aktiivihiili-elektrodi kykeni varastoimaan noin yhden painoprosentin verran vetyä. Tämä on massayksikköä kohti jo verrattavissa kaupallisiin litiumioni-akkuihin, vaikka protoniparisto on vielä kaukana optimoinnista. Kennon maksimijännite oli 1,2 volttia.
Protoneista akkujen varausten siirtäjä?
Vuonna 2019 Oregonin valtionyliopiston tutkijat esittelivät havaintonsa, että 1800-luvulla esitetyllä kemiallisella mekanismilla on potentiaalia mullistaa energian varastointi suuritehoisille sovelluksille, kuten ajoneuvoille tai sähköverkoille.
Tutkimusryhmä osoitti, että diffuusio ei välttämättä ole tarpeen kuljettamaan ionisia varauksia akkuelektrodin hydratoituun rakenteeseen.
Tehty teoreettinen löytö saattaa siirtää koko suuritehoisen sähkökemiallisen energian varastoinnin paradigman uudenlaisiin elektrodien suunnitteluperiaatteisiin.
Nykyään akkutekniikan suurin osa huomio liittyy metalli-ioneihin. Tieteilijäryhmä tutki kuitenkin vedyn protonia. He tutkivat myös vuoden 1806 kemisti Theodor von Grotthussin teoriaa varaussiirrosta elektrolyyteissä.
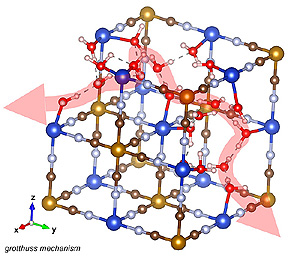 Grotthuss-mekanismissa sähköinen varaus siirtyy, kun vetyatomi silloittaa kaksi vesimolekyyliä ja vaihtaa yhdestä molekyylistä toiseen. Tämä laukaisee samanlaisten siirtymien ketjun koko hilan vetysidosten verkossa.
Grotthuss-mekanismissa sähköinen varaus siirtyy, kun vetyatomi silloittaa kaksi vesimolekyyliä ja vaihtaa yhdestä molekyylistä toiseen. Tämä laukaisee samanlaisten siirtymien ketjun koko hilan vetysidosten verkossa.
Nämä korreloidut paikalliset siirtymät johtavat protonien kaukokuljetukseen, joka on hyvin erilainen kuin metalli-ionien kulku nestemäisissä elektrolyyteissä. Tavallaan protoni siirtyy vesimolekyylien ketjun toisesta päästä toiseen päähän ilman massansiirtoa vesiketjun sisällä.
Kyseessä olisi tehokas varauksen siirto protonien avulla, joiden ei tarvitse ionien tapaan vääntäytyä kiderakenteen kapeiden aukkojen läpi.
Teoreettisessa tutkimuksessaan tutkijat osoittivat menetelmälle melkoisia suorituskykyarvoja.
Vaikka tutkijat ovat innoissaan havainnoistaan, Xiulei Ji varoittaa, että tässä on vielä tehtävää, jotta saavutettaisiin ultranopea lataus ja purku akuissa, jotka olisivat käytännöllisiä kulkuneuvojen tai verkkojen energian varastointiin.
Orgaaninen protoniakku
Uppsalan yliopiston tutkijat ovat kehittäneet orgaanisen protoniakun, joka voidaan ladata suoraan aurinkokennolla ilman erityistä latauselektroniikkaa.
Akun aktiiviseksi materiaaliksi on valittu kinonit eli orgaaniset hiiliyhdisteet. Niillä on kyky absorboida tai emittoida vetyioneja eli protoneja, lataamisen ja purkautumisen aikana. Elektrolyyttinä on käytetty hapanta vesiliuosta.
Tutkijoiden mukaan akku voidaan ladata vain sekunneissa vakiojännitteellä ja että kyseinen lataus on hyödyllinen orgaanisen akun vakaudelle verrattuna tavanomaiseen vakiovirtalataukseen.
Akkua voidaan käyttää esimerkiksi lämpömittarin virrantuottoon. Tulevaisuuden kehitystyönä on sekä akun jännitteen (0,4 V) että kapasiteetin (60 mAh g−1) parantaminen optimoimalla CRP-komponentteja.
Huhtikuu 2020
